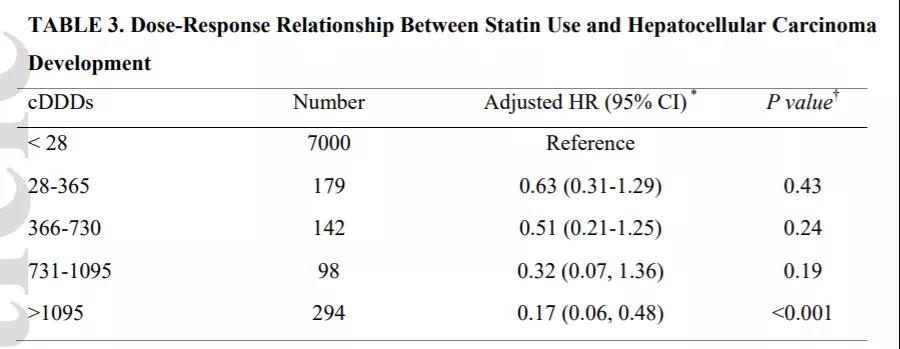
近年来,肿瘤诊疗领域耕耘不辍,丰收如期。聚焦到胆管癌治疗领域,新方向的探索犹如千帆竞发,临床研究犹如百舸争流,展现出一派繁荣景象。中国医学论坛报特邀复旦大学附属华东医院普外科姜翀弋教授回顾和盘点胆管癌靶向治疗进展。数往知来,笃行致远,以期推动胆管癌诊疗水平进一步提升,为患者带来更多的希望和福祉。 姜翀弋 教授 复旦大学附属华东医院 普外科行政副主任 肝胆胰脾外科学科带头人 主任医师,博士研究生导师 中国抗癌协会胰腺癌专委会微创诊治学组委员兼秘书 中国研究型医院学会胰腺疾病专委会委员 中国中西医结合学会围术期专委会委员 国际肝胆胰协会中国分会胆道结石专委会委员 上海市医师协会普外科医师分会委员 上海市医学会普外科分会胰腺学组委员 & 肠内肠外营养学组委员 上海市抗癌协会青年常务理事 & 胰腺癌学组委员 & 胆道学组委员 上海市中西医结合学会胰腺病学组委员 “中华医学科技进步奖”一等奖 “教育部科技进步奖”二等奖 中华医学会“外科金手指手术比赛”全国一等奖 《腹腔镜/机器人辅助胰腺癌根治术中国专家共识(2022)》执笔人 众所周知,胆管癌致死率极高,5年生存率不足10%1。尽管手术是目前最理想的根治性治疗手段,但60%~70%的患者在就诊时已失去机会2;此外,胆管癌对放化疗治疗不敏感,耐药现象亦不鲜见3,中晚期胆管癌患者的中位生存时间仅约24个月4。近年来,随着基因组学和生物信息学技术的蓬勃发展,肿瘤学进入了精准治疗时代,胆管癌靶向治疗也逐渐崭露头角,针对成纤维细胞生长因子受体(FGFR)、异柠檬酸脱氢酶(IDH)等靶点研制的靶向药物在胆管癌治疗中展现了良好的有效率及生存数据,具有特异性高和毒性低的优势5-6,为胆管癌治疗带来了一线曙光。 表皮生长因子受体(EGFR)激活可促进癌症细胞的增殖和转移7,血管内皮生长因子(VEGF)/血管内皮生长因子受体(VEGFR)信号通路是介导肿瘤新生血管生成的主要途径8。早期胆管癌靶向探索主要致力于EGFR和VEGF/VEGFR等抑制肿瘤发生和发展的相关靶点,但取得的成果却不尽人意。 一项单臂Ⅱ期临床研究(NCT01267344)表明,EGFR抑制剂联合化疗在晚期胆道肿瘤中疗效甚微9,随机对照研究结果显示,与单用化疗相比,EGFR抑制剂联合化疗未能显示出显著的治疗优势,且并未改善患者的总生存(10.6 vs. 9.8个月,P=0.91)10-12。而另一项Ⅲ期临床研究(NCT01149122)显示,EGFR抑制联合剂联合化疗并未显著改善患者的中位无进展生存(5.8 vs 4.2个月,P=0.087)12。此外,关于VEGFR抑制剂的探索也未取得突破性成果。尽管部分抗血管生成药物在治疗晚期胆管癌患者中显现出了潜力,但大量抗血管生成药物并未在胆管癌患者中显示出临床获益13。 FGFR基因变异在尿路上皮癌、乳腺癌及胆管癌等多癌种中广泛存在,主要通过FGFR基因扩增、突变、染色体易位以及配体依赖性活化等机制,引起FGFR信号异常。异常的FGFR信号可促进肿瘤细胞增殖、存活、迁移和血管生成,从而引起恶性肿瘤的发生和发展14。 pemigatinib是首个在美国获批用于治疗FGFR2基因融合/重排的晚期胆管癌经治患者的靶向药物,于2020年获批。2023年美国癌症研究协会(AACR)年会上公布了pemigatinib治疗中国晚期胆管癌人群II期研究的总生存期(OS)数据。研究结果显示,接受Pemigatinib治疗的胆管癌患者的12个月、18个月和24个月的生存率分别为73.3%、66.5%和41.4%,mOS为23.9个月,且安全性良好,无新发不良事件出现15。 Infigratinib紧随其后,2021年FDA批准其用于治疗携带FGFR2融合或重排的局部晚期或转移性胆管癌经治患者。在经治、不可切除的局部晚期/转移性胆管癌患者中展现了良好的疗效,客观缓解率(ORR)为23.1%16。Futibatinib则是一种高选择性、不可逆的口服酪氨酸激酶抑制剂(TKI),对FGFR1-4均有抑制作用,2022年FDA批准Futibatinib作为FGFR2突变胆管癌的晚期一线治疗方案。FOENIX-CCA2研究中位随访17.1个月,结果显示经治的FGFR2融合/重排的肝内胆管癌患者的中位无进展生存期(mPFS)为9.0个月,OS为21.7个月17。 不断更新的研究数据表明,FGFR抑制剂在治疗复发性/转移性胆管癌方面展现了令人鼓舞的疗效和广阔的治疗前景。除上述研究之外,Erdafitinib、Derazantinib等多种FGFR抑制剂治疗胆管癌的临床研究也正在积极进行当中。同时,靶向治疗与化疗或免疫治疗联合的晚期胆管癌治疗策略也在不断探索中。 IDH是三羧酸循环的关键酶,其功能是将异柠檬酸转化为α-酮戊二酸(α-KG)并产生还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。IDH基因突变将导致酶活性位点结构及活性的改变,因此IDH1突变后不再生成NADPH,转为消耗NADPH生成2-羟基戊二酸(2-HG)。在正常生理条件下,低水平的2-HG可被组织清除。然而,IDH突变将导致2-HG产生过多,超出组织的清除能力,进而可能诱发肿瘤。具体而言,IDH1突变多见于实体肿瘤,是胆管癌的常见突变之一,在胆管癌中发生率约为7~28%,而IDH2突变则更多见于血液系统肿瘤18-20。 Ivosidenib(AG-120)是一种靶向IDH1突变的小分子抑制剂。ClarIDHy研究是一项全球、双盲、随机的III期临床试验,旨在评估Ivosidenib与安慰剂相比治疗既往经治的IDH1突变型晚期胆管癌患者的疗效和安全性。研究结果表明:Ivosidenib组(123例)中位治疗持续时间(mDOT)为2.8个月,安慰剂组(59例)仅为1.6个月。安慰剂组中43例受试者(70%)进展后交叉到Ivosidenib组且mDOT为2.7个月。Ivosidenib组和安慰剂组的mOS分别为10.3个月和7.5个月(HR=0.79,P=0.093),秩保持结构失效时间(RPSFT)模型校正的安慰剂组mOS为5.1个月(HR=0.49,P<0.0001)。Ivosidenib组mPFS为2.7个月,较安慰剂组显著延长1.3个月(HR=0.37,P<0.0001)。在疾病控制率(DCR)方面,Ivosidenib组为53%,包括2%部分缓解(PR)和51%疾病稳定(SD),而安慰剂组DCR为28%,没有PR的受试者。此外,研究显示Ivosidenib还具有可耐受的安全性,提示Ivosidenib可为晚期IDH1突变型胆管癌带来更多临床获益。 基于ClarIDHy研究中颇具临床应用前景的数据,FDA已于2021年8月批准Ivosidenib用于既往接受过治疗的局部晚期或转移性IDH1突变型胆管癌的患者,目前Ivosidenib已作为IDH1突变型胆管癌二线治疗的1类推荐被纳入NCCN指南,且在2023年中国临床肿瘤学会(CSCO)中,Ivosidenib也获得了针对IDH1突变型晚期胆道恶性肿瘤二线治疗的I级推荐(1A类证据)21,为临床提供了一种新的治疗选择。 BRAF是丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)信号通路的关键分子,约5%胆管癌患者存在BRAF突变,以BRAF V600E突变为主22。BRAF突变与较高的TNM分期、对全身化疗的耐药性和较差的生存率相关23。 Dabrafenib是一种RAF激酶的ATP竞争性抑制剂,并靶向突变的BRAF,如BRAF V600E,其可通过阻止致癌通路的结构性激活,从而抑制肿瘤增殖24。Trametinib为MEK1、2抑制剂25。Dabrafenib联合Trametinib可进一步抑制BRAF V600E突变肿瘤的生长。研究显示,Dabrafenib联合Trametinib治疗胆道癌患者的ORR为51%,mPFS和mOS分别为9个月和14个月26。目前,BRAF抑制剂Dabrafenib和MEK抑制剂Trametinib的双靶联合治疗策略已获批用于BRAF V600E突变的患者。 NTRK基因融合已被发现是明确的致癌驱动因素,且与多种肿瘤的发生发展有关27。对于NTRK融合突变的患者,给予相应靶向治疗展现出显著的疗效。2021年ASCO大会公布了Larotrectinib的疗效数据:ORR高达75%,PFS为35.4个月,中位缓解持续时间(mDoR)达49.3个月28。同年ESMO大会公布的Entrectinib研究数据显示:中位随访25.8个月,ORR达61.2%,mDoR达20.0个月,mPFS为13.8个月,mOS为33.8个月29。基于现有研究,FDA已批准NTRK抑制剂Larotrectinib和Entrectinib用于治疗具有NTRK基因融合的转移性或不可切除实体瘤患者30-32。 高频/经典靶点,探索不停,未来可期 TP53/ target=_blank class=infotextkey>P53、SMAD4作为胆管癌中高频的突变基因,对指导靶向药物的未来研发方向及制定治疗策略方面具有重大意义33。BI 907828是一种高效的口服小分子MDM2-P53拮抗剂,在正在进行的Ⅰ期研究中,BI 907828已在晚期/转移性实体瘤(包括胆道恶性肿瘤和胰腺导管腺癌)中显示出初步的抗肿瘤活性。Brightline-2是一项Ⅱ期临床试验(NCT05512377),旨在评估BI 907828在胆管癌中的疗效34。SMAD4作为肿瘤抑制因子在肿瘤发生和进展等诸多生物学过程中同样发挥了重要作用。尽管SMAD4基因突变在胆管癌发生突变率高达20%。但在胆管癌领域,靶向SMAD4的药物仍待探索。 除上述高频靶点之外,针对其他经典靶点的研究与靶向治疗药物的开发也在持续探索中。一项回顾性研究对接受过HER2/neu靶向治疗的晚期胆管癌患者分析发现并未观察到影像学上的疗效35。此外,针对BRCA、JAK/STAT异常激活及cMET扩增和过表达等胆管癌相关靶点的探索尚处于早期阶段。 随着下一代测序(NGS)技术的发展,相信将会有更多的特异性靶向药物问世,也期待未来的临床试验能够为临床实践提供更多的循证医学证据,从而进一步提升胆管癌患者的治疗效果和生活质量。 参考文献: 1. Renzulli M,et al. Cancers (Basel). 2021 Jul 2;13(13):3336. 2. Massironi S,et al. Cells. 2020 Mar 11;9(3):688. 3. Rizvi S, et al. Nat Rev Clin Oncol. 2018 Feb;15(2):95-111. 4. Lowery MA, et al. Lancet Gastroenterol Hepatol. 2019 Sep;4(9):711-720. 5. 李博,等.临床外科杂志,2020,28( 8 ):790-792. 6. 樊非睦,等.临床外科杂志,2023, 31 (04): 394-397. 7. 张锦锦,等.中国生物制品学杂志,2018,31(04):425-430. 8. Ferrara N, et al. Nat Med. 2003;9(6):669-676. 9. CHEN J S, et al. Ann Oncol, 2015, 26(5):943-949 10. Leone F, et al. Cancer, 2016, 122(4):574-581. 11. MALKa D, et al. LancetOncol, 2014, 15(8):819-828. 12. Lee J, et al. Lancet Oncol, 2012, 13(2):181-188. 13. 黄慧聪,等. 国际外科学杂志,2023,50(08):567-571. 14. 金运成, 等. 中华肿瘤防治杂志, 2023,30(22):1393-1398. 15. Abstract CT153: Pemigatinib in Chinese patients with advanced/metastatic or surgically unresectable cholangiocarcinoma Including FGFR2 fusion or rearrangement: Updated overall survival from an open-label, single-arm, multicenter Phase II study 16. Javle M, et al. Lancet Gastroenterol Hepatol. 2021 Oct;6(10):803-815. 17. Goyal L, et al. N Engl J Med. 2023 Jan 19;388(3):228-239. 18. Chen C, et al. Pathol Oncol Res. 2021 Oct 15;27:1609879. 19. Pirozzi CJ, et al. Nat Rev Clin Oncol. 2021 Oct;18(10):645-661. 20. Cleven AHG, et al. Clin Sarcoma Res. 2017; 7:8. 21. 2023 CSCO胆道恶性肿瘤指南 22. Goeppert B,et al.Mod Pathol, 2014, 27(7): 1028-1034. 23. Acher AW, et al. Cancers (Basel). 2021 Oct 15;13(20):5169. 24. Subbiah V et al. Lancet Oncol 2020 Sep; 211234. 25. Von P, et al. J Exp Clin Cancer Res 2022;41(1):51. 26. Subbiah V, et al.Lancet Oncol. 2020 Sep;21(9):1234-1243. 27. Rizzo A, et al. Cancer Treat Res Commun. 2021;27:100351. 28. Carsten Bokemeyer, MD,et al. Oral 2002.2021 ASCO Virtual Congress. 29. L. Bazhenova, et al. Abstract 533P.2021 ESMO Virtual Congress. 30. Drilon A,et al. N Engl J Med. 2018;378(8):731-739. 31. Doebele RC, et al. Lancet Oncol. 2020;21(2):271-282. 32. Subbiah V, et al. Lancet Oncol. 2022;23(10):1261-1273. 33. Wang Z, et al.Cell Death Differ. 2022 May;29(5):911-920. 34. GRASsian AR ,et al.Current Opinion in Gastroenterology ,2014,30( 3):295-302. 35. Javle M, et al. J Hematol Oncol, 2015, 8: 58.